Les sirtuines sont des enzymes qui régulent d’importants processus biologiques. Il y a sept sirtuines connus chez les humains (SIRT1 à SIRT7). Elles ont une activité soit de désacétylase, de mono-ADP-ribosylation, de désuccinylase ou d’autres activités similaires. Les sirtuines sont présentes dans pratiquement tous les organismes, incluant les bactéries. Elles sont très intéressantes pour les chercheurs et le public grâce à leur rôle dans la régulation du vieillissement, des rythmes circadiens, de l’inflammation, de la résistance au stress, et des fonctions mitochondriales.
Source de l’image: Nat Rev Drug Discov. 2008 Oct;7(10):841-53. doi: 10.1038/nrd2665.
Comme mentionné ci-dessus, il y a sept sirtuines chez les humains. Les SIRT1, 2, 3, 6 et 7 se trouvent dans le noyau cellulaire. Les SIRT1 et 2 se trouvent également dans le cytoplasme, la SIRT3 dans la mitochondrie. Les SIRT4 et 5 se trouvent exclusivement dans la mitochondrie. Les SIRT1, 2 et 3 ont toutes une activité de désacétylase.
Contrairement à la plupart des désacétylases, les sirtuines allient l’activité de désacétylase avec l’hydrolyse de la coenzyme de nicotinamide adénine dinucléotide (NAD). Cette réaction produit de la nicotinamide, qui agit comme un inhibiteur de l’activité des sirtuines. Grâce à ce lien, l’activité des sirtuines est directement régulée par l’état énergétique de la cellule reflété par la quantité relative de NAD+, de NADH, et de nicotinamide.
Vieillissement et État Énergétique
Des études sur la restriction calorique ont révélé que l’apport et la transformation d’énergie sont fortement liées au vieillissement. Des organismes aussi différents que les nématodes et les souris peuvent voir leurs vies significativement prolongées simplement en limitant leur apport en calories. Même si à travers l’histoire, les organismes ont souvent été sujets à des restrictions caloriques, les carences nutritionnelles des régimes naturellement restreints tendent à causer des maladies et la mort avant que les bénéfices de la famine ne soient révélés. Cependant, dans les années 30, des études de laboratoire sur les régimes de bonne qualité, qui étaient simplement des régimes restreints en calories, ont révélé le lien entre l’apport énergétique et la longévité.
Le lien direct entre la restriction calorique et la longévité est toujours en quelque sorte un mystère, mais il devient clair que les sirtuines jouent un rôle important. La restriction calorique associée à un régime adéquat du point de vue nutritionnel a beaucoup d’effets profonds sur le corps : elle réduit le métabolisme de base, elle augmente la réponse à l’insuline, et elle réduit l’inflammation et le stress oxydant. Les sirtuines joueraient un important rôle de régulation dans toutes ces réponses à l’apport en calories.
SIRT1 et Vieillissement
La SIRT1 jouerait plusieurs rôles dans le vieillissement et les maladies liées à l’âge, telles que la maladie d’Alzheimer, le cancer, et le diabète de type II. Le ptérostilbène, comme son cousin phénolique, le resvératrol, activerait la SIRT1 et pourrait allonger la durée de vie et fournir une protection contre les maladies du vieillissement.
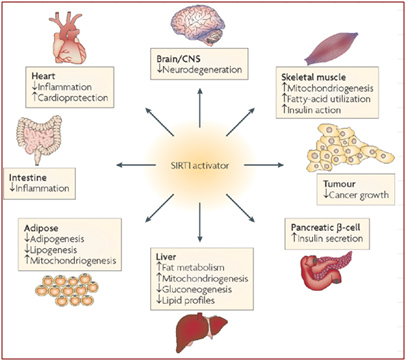
Des études par knockdown de siRNA sur les souris indiquent que la SIRT1 est impliquée dans la régulation de l’expression d’au moins 200 gènes différents qui affectent toutes sortes de parties du corps. Elle réduit l’inflammation, peut aider à prévenir la dégénération des neurones, est impliquée dans la régulation de l’insuline, affecte plusieurs aspects du métabolisme, et pourrait protéger du cancer et des maladies cardiovasculaires. Ces résultats montrent que l’activation de la SIRT1 pourrait fournir des bénéfices globaux sur la santé contre la plupart des grandes maladies modernes de l’homme en altérant fondamentalement le schéma d’expression des gènes.
Dans le noyau cellulaire, la SIRT1 semble réguler l’expression des gènes principalement grâce à des mécanismes épigénétiques. Son activité de désacétylase altère la fonction des histones, qui à leur tour altèrent le schéma d’expression d’autres gènes. Le terme « épigénétique » se réfère simplement aux altérations des fonctions génétiques dues aux changements des schémas d’expression plutôt qu’à de véritables mutations du matériel génétique.
La SIRT1 désacétyle les ADN méthyltransférases (DNMT1), qui jouent un rôle important dans le maintien de la méthylation des îlots CpG. La méthylation des îlots CpG des régions promotrices désactive des schémas génétiques entiers, et la SIRT1 améliore directement l’activité du DNMT1. Les gènes sont également désactivés globalement en les enveloppant solidement autour d’histones pour former l’hétérochromatine. La SIRT1 désacétyle les histones, les empêchant de former l’hétérochromatine. Lorsqu’il y a une carence en NADH et une augmentation de NAD+ (comme cela se produit en cas de restriction calorique), la SIRT1 est activée, les gènes restent à l’état d’euchromatine et s’expriment. Ainsi, la SIRT1 peut réguler les niveaux d’expression d’un vaste nombre de gènes en réponse à l’état énergétique des cellules grâce à des mécanismes relativement simples.
La Sénescence Cellulaire
La sénescence cellulaire est fondamentalement la vieillesse d’un point de vue cellulaire. Les cellules somatiques de la plupart des organismes finissent par subir la sénescence et cessent de se diviser. Chez les humains, la sénescence progressive de la population de cellules souches à travers le temps semble jouer un rôle majeur dans le vieillissement.
La sénescence des cellules lésées ou inutiles, comme après une blessure, des dommages cellulaires excessifs, ou durant l’embryogenèse, est une fonction biologique importante dans une vie normale et saine. De nombreuses populations cellulaires sont produites régulièrement, elles mûrissent, puis subissent la sénescence et sont rejetées par le corps, remplacées par des cellules fraîches et neuves. Les cellules cutanées et sanguines sont des exemples importants d’organes qui se reposent sur la sénescence pour maintenir un fonctionnement correct tout au long de la vie. Cependant, à mesure que les organismes vieillissent, d’autres types de cellules deviennent progressivement sénescentes et cessent de se diviser (Limite de Hayflick). Beaucoup de cellules sénescentes subissent l’apoptose.
La réduction graduelle des télomères avec chaque division cellulaire est un déclencheur majeur de la sénescence. Si les télomères raccourcissent jusqu’à une taille critique, cela active des mécanismes qui détectent les dommages sur l’ADN et peuvent déclencher la sénescence cellulaire. Tout type de dommage considérable sur l’ADN, tel que la radiation ou l’oxydation, peut déclencher la sénescence. L’expression de trois protéines différentes, p53, p16INK4a, et ARF, est importante pour la sénescence.
La p16INK4a et l’ARF sont en réalité transcrites par la même séquence génétique, mais elles codent pour des protéines différentes. La p16INK4a inhibe les kinases cycline-dépendantes CDK4 et CDK6. L’ARF désactive une des protéines qui dégrade la p53, la stabilisant ainsi. Dans les cellules jeunes, le locus p16INK4a/ARF ne s’exprime pas, mais à mesure que les cellules vieillissent, les niveaux de production augmentent progressivement. Curieusement, la restriction calorique retarde l’augmentation de p16INK4a/ARF associée à l’âge.
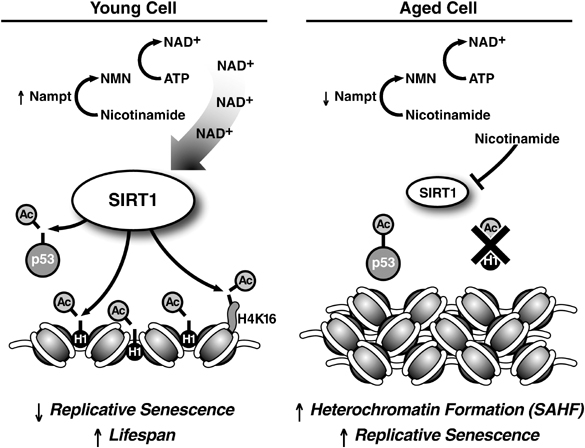
La SIRT1 agit à la fois pour inhiber l’expression de p16INK4a/ARF et réprimer son activité. La restriction calorique augmente l’expression de la SIRT1, et l’action inhibitrice de la SIRT1 sur le locus p16INK4a/ARF jouerait un rôle important sur le lien entre restriction calorique et retardement de la sénescence. Durant la sénescence, la SIRT1 est régulée à la baisse. La chromatine se forme en hétérochromatine compacte, et des schémas altérés de méthylation des îlots CpG (avec hypométhylation globale) surviennent en lien avec le jeune âge. La SIRT1 désacétyle également la protéine p53, en la désactivant et en l’empêchant de forcer la sénescence cellulaire.
Source de l’image: Oncogene (2007) 26, 5489–5504; doi:10.1038/sj.onc.1210616
En résumé, dans les cellules jeunes, il y a un haut niveau de protéine SIRT1 et de NAD+ (voir tableau de gauche ci-dessus). La SIRT1 active laisse l’euchromatine ouverte, désactive la p53, inhibe le p16INK4a/ARF, et favorise les schémas normaux de méthylation des îlots CpG. A mesure que les cellules vieillissent, l’activité de la SIRT1 décline (tableau de droite ci-dessus). La chromatine s’agglutine en hétérochromatine, la p53 et le p16INK4a/ARF deviennent plus actifs, et les schémas de méthylation des îlots CpG commencent à décliner. Si un dommage sur l’ADN survient, la cellule deviendra plus sénescente. Certaines personnes supposent que la sénescence est un mécanisme utile, délibérément évolué, destiné à éliminer les cellules endommagées qui pourraient sinon devenir cancéreuses, mais les vieux organismes ont une accumulation de cellules sénescentes alors que les jeunes organismes non.
SIRT1 et Cancer
La dérégulation de la p53 joue un rôle majeur dans le cancer. Normalement, la p53 agit comme une sorte de chien de garde sur l’intégrité du génome et agit pour tuer toute cellule dont l’ADN est endommagé en induisant la sénescence et l’apoptose. Afin de devenir des cellules cancéreuses, les cellules mutées doivent éviter ce mécanisme d’une manière ou d’une autre pour pouvoir se diviser et devenir permanente.
L’importance de la p53 dans le cancer est démontrée par l’existence du syndrome de Li-Fraumeni. Dans ce syndrome, les enfants héritent d’une seule bonne copie du gène p53. Les familles porteuses d’une seule bonne copie du gène p53 souffrent d’un taux plus élevé du nombre de cancers divers, dont beaucoup se développent à un très jeune âge. Si les individus survivent les premiers cancers qu’ils développent, ils continueront à développer des cancers toute leur vie.
Comme discuté ci-dessus, la SIRT1 agit pour réguler à la baisse la p53. Dans certains cancers cellulaires, la p53 elle-même devient mutée. Dans d’autres cancers, la SIRT1 est sur-exprimée et peut agir pour bloquer la fonction de la p53. Certains chercheurs supposent que l’inhibition de l’activité de la SIRT1 est un mécanisme possible de traitement de certains cancers.
Une remarque intéressante, et quelque peu déconcertante, est que la restriction calorique est à la fois efficace dans la prévention de certains cancers et dans le ralentissement ou l’arrêt de la croissance de plusieurs cancers. Cependant, la restriction calorique devrait augmenter les niveaux de SIRT1, qui bloque l’activité de chien de garde de la p53 sur le génome. Une pièce de ce puzzle pourrait être le rôle de la SIRT1 dans la réparation de l’ADN. La SIRT1 paraît capable d’activer d’importantes protéines de réparation des cassures double brin de l’ADN. Cet effet intéressant aiderait à conserver les cellules plus jeunes en bonne condition génétique pendant bien plus longtemps.
SIRT1 et Inflammation
L’inflammation joue un rôle important dans le corps en combattant les infections et en soignant les blessures sévères. Cependant, l’inflammation chronique serait une cause majeure de maladie cardiovasculaire, de syndrome métabolique, de diabètes, d’arthrose, et de maladies neurodégénératives. L’inflammation dépend des voies de l’insuline (glucose) et des acides gras libres. La restriction calorique, en particulier la restriction en glucose, réduit directement l’inflammation en régulant négativement ces voies.

Leave a comment